Physik, Chemie, Biologie & Medizin: Der Spin macht den Unterschied
Forschungsbericht (importiert) 2010 - Max-Planck-Institut für Polymerforschung
In der modernen Welt haben sich physikalische Messmethoden, die auf dem Effekt der Magnetresonanz basieren, zu bedeutenden Werkzeugen in der Forschung und Entwicklung und des täglichen Lebens entwickelt. Die kernmagnetische Resonanzspektroskopie (nuclear magnetic resonance, NMR) hat die Analyse chemischer Strukturen, z.B. für die Wirkstoff- und Katalysatorforschung, seit den 1960er-Jahren stark vereinfacht und zuverlässiger gemacht. Heute vergehen oft nur einige Minuten, bis man nach einem Synthesevorgang weiß, ob er erfolgreich war. In ihrer bildgebenden Form, der Magnetresonanztomographie (MRT), hat die kernmagnetische Resonanz als Methode von herausragendem diagnostischem Wert Einzug in den klinischen Alltag gehalten. Mittels einer weiteren NMR-Methode, der Elektronenspinresonanz (ESR), ist es unter anderem möglich, freie Radikale nachzuweisen.
Alle Magnetresonanzmethoden nutzen eine quantenmechanische Eigenschaft von Teilchen, den sogenannten Spin. Der Spin ist mit einem Eigendrehimpuls vergleichbar, der sich vereinfacht wie eine Kompassnadel verhält und sich im von außen angelegten Magnetfeld ausrichtet. Werden nun zusätzlich elektromagnetische Wellen eines bestimmten, resonanten Frequenzbereiches eingestrahlt1, so kann man die Spinausrichtung umdrehen und in einen höheren Spin-Energiezustand anheben. Aus der Reaktion aller Spins auf die Strahlung bzw. aus dem Rückfall in die ursprüngliche, energieärmere Spinausrichtung können dann Rückschlüsse über ihre Umgebung gewonnen werden. Ungepaarte Elektronen, wie sie in Radikalen vorkommen und viele Atomkerne, wie Wasserstoff (1H und 2H) und das Kohlenstoffisotop 13C, besitzen einen messbaren Elektronen- bzw. Kernspin. In der Magnetresonanzspektroskopie und -tomographie wird der Spin als Spion eingesetzt. Sein spezifisches Verhalten gibt Einblick in den Aufbau von Materie oder Gewebe oder bildet die räumliche Struktur und Funktion von komplizierten Molekülen wie Proteinen ab. Dabei macht man sich zunutze, dass – je nach chemischer Umgebung um einen zu detektierenden Kernspin – die lokal vom Spin wahrgenommenen Magnetfelder ein wenig unterschiedlich sind. Man kann beispielsweise den Kernspin eines Wasserstoffatoms, das chemisch an ein Stickstoffatom gebunden ist, deutlich von einem Wasserstoffatom unterscheiden, das mit einem Kohlenstoffatom verbunden ist. Die magnetischen Wechselwirkungen zwischen zwei Elektronenspins enthalten entscheidende Information, die mittels einer in Mainz mitentwickelten ESR-Methode, der Elektronenspin-Doppelresonanz (DEER), nun entschlüsselt werden können. Damit ist es möglich, Abstände im Bereich von bis zu acht Nanometer (millionstel Millimeter) zwischen den Spins zu ermitteln. Dieser Abstandsbereich ist sehr interessant, da er der Größenordnung vieler Strukturen der Nanotechnologie sowie biologischer Makromoleküle entspricht.
Seit ihrer Entdeckung Ende der 1940er-Jahre haben die Methoden der Magnetresonanz eine rasante technische Entwicklung genommen, die die Grundlage für viele Anwendungen in der heutigen Zeit gelegt hat. Die Magnetresonanz ist dabei weit davon entfernt, methodisch und technisch abgeschlossen zu sein und besitzt noch viel Potenzial, das es zu erschließen gilt.
Im Folgenden werden zwei Zukunftsfelder der Magnetresonanz vorgestellt, die in der Abteilung Polymer-Spektroskopie (Prof. Dr. Hans W. Spiess) am MPI für Polymerforschung (MPI-P) entdeckt bzw. entwickelt wurden.
Außen weich, innen hart – Das Transportprotein Albumin kann dank flexibler Oberflächenstruktur unterschiedliche Fracht transportieren
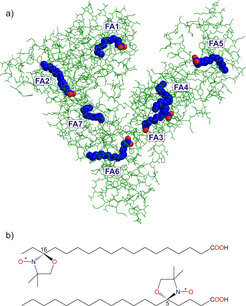
Albumin ist der Universaltransporter im menschlichen Blut. Das Protein befördert Fettsäuren, Hormone oder Medikamente zu ihren Zielorten im Körper. Bisherige Untersuchungen von Albumin-Kristallen zeigen lediglich Momentaufnahmen seiner räumlichen Struktur. Im Blut verändert das Albumin jedoch häufig seine Gestalt. Mittels Methoden der Elektronenspinresonanz ist es gelungen, dem Protein bei der Arbeit zuzusehen und seine räumliche Struktur unter natürlichen Bedingungen zu untersuchen. Dabei haben wir entdeckt, dass die zentralen Regionen des Albumins starr sind, während die Außenbereiche flexibel ihre Form ändern können (s. Abb. 1) [1].
Albumin-Moleküle sind mit Fettsäure-Molekülen beladen, die wie Nägel in eine Wand in die Proteine eindringen. Der Kopf der Fettsäuremoleküle hingegen bleibt an der Oberfläche. Röntgenstrukturuntersuchungen an Albumin in kristalliner Form haben gezeigt, dass die Fettsäure-Moleküle nicht wie erwartet symmetrisch verteilt sind, sondern dass es Bereiche des Proteins gibt, in denen gehäuft Fettsäuren an das Protein binden [2].
Ursprünglich sollten unsere Forschungen ermitteln, ob die Fettsäure-Moleküle genauso verteilt sind, wenn die Proteine unter lebensähnlichen Bedingungen in Wasser gelöst sind. Aufgrund von Studien gibt es vermehrten Grund zu der Annahme, dass die Funktion von Proteinen nicht allein durch ihre räumliche Struktur bestimmt wird. In Lehrbüchern wird die Beziehung zwischen der Form eines Proteins und seiner Funktion oft als „Schlüssel-Schloss-Prinzip“ bezeichnet: Proteine besitzen jeweils speziell geformte Taschen, die nur Moleküle aufnehmen, die dort hineinpassen. Nach neueren Erkenntnissen ist die Form von Proteinen nicht starr, sondern flexibel, was für ihre Funktion wesentlich zu sein scheint. Dies trifft besonders auf Albumin zu, in dessen „Schloss“ viele „Schlüssel“ passen müssen, nämlich viele verschiedene Arten zu transportierender Moleküle.
Um dies nachweisen zu können, wurden mit Fettsäuren beladene Albumin-Moleküle in Wasser gelöst und die Lösung binnen Millisekunden eingefroren. Die Abstände zwischen den ans Albumin gebundenen Fettsäuren wurden anschließend per DEER-Spektroskopie gemessen [1]. Dieses Verfahren sorgt dafür, dass Proteine in allen Phasen ihrer Dynamik – also mit unterschiedlichen Formen – fixiert sind, anstatt nur in der energieärmsten Form wie bei kristallographischen Untersuchungen vorzuliegen. Der gesamte Bewegungsspielraum der Proteine wird dabei erfasst.
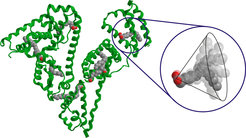
Das Ergebnis erbrachte eine neue Überraschung: Es zeigte sich, dass die meisten Enden der langkettigen Fettsäuren (s. Abb. 1) einen gleichmäßigen Abstand von etwa 3,6 Nanometer voneinander haben (s. Abb. 2). Die Zugänge zu den Kanälen, die die Fettsäuren aufnehmen, sind also gleichmäßiger und homogener auf der Proteinoberfläche verteilt als bislang vermutet. Das wiederum erlaubt die Schlussfolgerung, dass die Oberflächenstruktur des Proteins in Lösung eine höhere Symmetrie aufweist als in kristalliner Form. Albumin kann seine Gestalt in Lösung offenbar flexibel ändern.
Die Untersuchung der Kopfgruppen der Fettsäure-Moleküle im Inneren des Proteins ergab ein anderes Bild. Unerwartet zeigte sich eine breite Verteilung der Abstände, wenn die Moleküle ungleichmäßig verteilt sind. Dies deutet darauf hin, dass der innere Teil des Proteins recht starr, der äußere dagegen flexibel ist. Durch diese Flexibilität wird eine höhere Symmetrie für die Eingänge der Bindungsstellen hergestellt.
In Zukunft soll diese Methode dazu dienen, die Fähigkeit von Albumin – etwa Medikamente zu transportieren – und die Veränderungen seiner räumlichen Struktur in anderen Lösungsmitteln zu untersuchen. Das Vorgehen bietet einen recht einfachen, aber exakten Weg, Proteine in ihrer natürlichen Umgebung zu erforschen. Mit hoher Wahrscheinlichkeit ist diese Methode auf weitere molekulare Transporter anwendbar.
Hyperpolarisierte Kontrastmittel: Leuchtende Zukunftsaussichten für die Magnetresonanztomographie
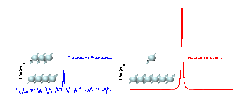
Trotz ihrer herausragenden Bedeutung für so unterschiedliche Wissenschaftsgebiete wie Physik, Chemie, Biologie oder Medizin haben die Methoden der Magnetresonanz ein ureigenes Problem: Das zur Verfügung stehende Signal von Elektronen- und vor allem von Kernspins ist sehr klein, d.h. die Magnetresonanz ist entsprechend wenig empfindlich. Im Vergleich zu anderen (z.B. optischen) Untersuchungsverfahren werden daher deutlich größere Probenmengen benötigt. Dieses Problem wird durch die nahezu gleiche Besetzung der beiden Energiezustände (Ausrichtungen), die ein Kernspin in einem äußeren Magnetfeld einnehmen kann, hervorgerufen (siehe Abb. 3). Daher ist die sogenannte Polarisation der Probe sehr gering (im ppm-Bereich) und das resultierende Messsignal entsprechend niedrig (s. Abb. 3). Bei der (normalen) thermischen Polarisation kann die Polarisation der Probe nur durch eine Verstärkung des Magnetfeldes oder durch eine Temperatursenkung erreicht werden. Diesen Maßnahmen sind aber enge technische oder physiologische (z.B. bei der medizinischen MRT) Grenzen gesetzt. Die Lösung des Problems sind neuartige Hyperpolarisationsverfahren [3], mit denen die Polarisation und damit das Signal der Probe um das bis zu 100.000-fache gesteigert werden kann.
Der mit der Hyperpolarisation einhergehende Signalgewinn ermöglicht völlig neue Anwendungen der Kernspinresonanz, wie z.B. die Messung sehr kleiner Probenmengen in schwachen Magnetfeldern, die Verfolgung chemischer Reaktionen in Echtzeit, die Darstellung der Lungenventilation oder die molekulare Bildgebung im lebenden Organismus.
Besonders spannend und vielversprechend ist der Einsatz von Hyperpolarisationsmethoden in der MRT. Der Einsatz hyperpolarisierter Substanzen ermöglicht hier z.B. neuartige Verfahren zur Tumordiagnostik. Tumore weisen aufgrund ihrer schlechten Blutversorgung meist einen sauerstoffarmen Metabolismus auf, d.h. es entstehen andere Stoffwechselprodukte als in gesundem Gewebe. Diese Unterschiede lassen sich mit der „normalen“ thermischen MRT kaum detektieren, da die Stoffwechselprodukte nur in geringen Konzentrationen vorliegen. Injiziert man allerdings eine hyperpolarisierte Substanz, die z.B. über den in jeder Zelle stattfindenden Zitronensäurezyklus umgesetzt werden kann, so lässt sich der Stoffwechsel dieser Substanz mit der Magnetresonanztomographie in jedem Teil des Körpers bildlich darstellen und ermöglicht so eine hervorragende Tumordetektion [4, 5]. Bislang konnte diese vielversprechende Technik allerdings ausschließlich in experimentellen Studien eingesetzt werden, da die Bildgebung mit einem für die MRT ungewöhnlichen Kernspin (nämlich 13C) durchgeführt werden musste und dieser nicht mit normalen klinischen Tomographen messbar ist.
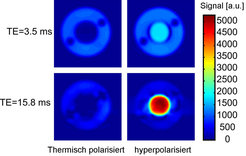
Am MPI-P wurde daher ein Verfahren entwickelt, das die molekulare Bildgebung auch mit dem Standardkernspin der MRT – dem Proton – ermöglichen und dadurch den Weg für einen Einsatz in der medizinischen Praxis freimachen soll. Eine besondere Schwierigkeit besteht in diesem Fall darin, eine kleine hyperpolarisierte Substanzmenge gegen das enorm starke Hintergrundsignal der vielen Wasserstoffkerne im Körper abzubilden. Zur Lösung dieses Problems diente nicht nur die große Signalverstärkung hyperpolarisierter Proben, sondern auch die Tatsache, dass einige Hyperpolarisationsmethoden NMR-Signale mit anderen Eigenschaften als die thermisch polarisierten Wasserstoffkerne generieren und eine genaue Unterscheidung ermöglichen. Eine spezielle chemische Hyperpolarisationsmethode [6] bringt z.B. hyperpolarisierte Moleküle hervor, die ein NMR-Signal mit einem anderen Zeitverlauf als ein normales, thermisches Signal besitzen. Dieser Unterschied kann durch geschickt gewählte Bildgebungsparameter dazu genutzt werden, die hyperpolarisierte Substanz selbst gegenüber einem sehr großen Überschuss von thermisch polarisierten Molekülen extrem sensitiv darzustellen [7] (siehe Abb. 4). Das hyperpolarisierte (innere) Signal im Bild wird dabei durch 700-mal weniger Kernspins hervorgerufen als das thermische (äußere) Signal. Bei Verwendung einer konventionellen Bildgebungssequenz ist das hyperpolarisierte Signal nur wenig stärker als das Signal der vielen Hintergrundkernspins. Eine sehr einfache Änderung der Bildgebungssequenz (die Einführung einer Wartezeit) erlaubt es jedoch, den Kontrast zwischen hyperpolarisierter Substanz und Hintergrund drastisch zu verbessern und die hyperpolarisierte Substanz förmlich aufleuchten zu lassen. Dieser exzellente Kontrast ist die Grundvoraussetzung für molekulare Bildgebung mittels klinischer MRT und wird in Zukunft zu einer breiten medizinischen Anwendbarkeit führen.
1 In der NMR und MRT werden Radiowellen, in der ESR Mikrowellen verwendet.



