Die molekulare Nase
Forschungsbericht (importiert) 2006 - Max-Planck-Institut für Polymerforschung
Einleitung
Am Max-Planck-Institut für Polymerforschung wird unter anderem an dem Konzept der synthetischen Biologie gearbeitet. Damit ist gemeint, dass synthetische Materialien, die im Labor entstanden sind, mit Materialien aus der Natur kombiniert werden. In diesem Forschungsansatz liegen interessante Herausforderungen – können wir doch durch entsprechende Methoden die Interaktion zwischen Chemie und Biologie auf molekularer Ebene untersuchen. Es geht dabei um die Kompatibilität zwischen den beiden Disziplinen – inwieweit akzeptieren natürliche Systeme künstliche Stoffe, wie zum Beispiel Polymere, als Umgebung oder interagieren vielleicht sogar mit ihr? Können wir auf der molekularen Ebene künstliche Komponenten in lebende Organismen einsetzen und damit ihre Eigenschaften variieren? Es ist ein bereits lang gehegter Traum der Menschheit, die Perfektion der Natur nachzuahmen. Die synthetische Biologie ist ein Ansatz in diese Richtung.
Eine konkrete Fragestellung bezieht sich dabei auf die Stabilisierung natürlicher Funktionskomplexe, wie zum Beispiel von Membranproteinen, die in einer künstlichen Umgebung ihre Struktur erhalten sollen und damit ihre interessanten Funktionen in einer künstlichen Matrix ausüben können sollen. Geruchsrezeptoren [1] sind ein Beispiel, das am MPI für Polymerforschung aus mehreren Gründen gewählt wurde: Diese Klasse von Membranproteinen ist bislang nicht in einer Form verfügbar, um mit den entsprechenden experimentellen Methoden untersucht werden zu können, hat aber sehr interessante Eigenschaften als Rezeptor. So stellen die Geruchsrezeptoren die molekulare Ebene des Geruchssinnes in allen Lebewesen dar. Aufgrund ihrer Selektivität können Lebewesen „riechen“, das heißt verschiedene molekulare Spezies aus der Luft aufnehmen und erkennen. Eine Sensorik, die mit diesen Proteinen aus der Natur arbeitet, wäre den konventionellen Analyse- und Sensorkonzepten überlegen. Eine Strategie, dieses Ziel zu erreichen, bietet die synthetische Biologie, nämlich die Kombination der Geruchsrezeptoren aus der Natur und einer geeigneten synthetischen Matrix, um diese zu stabilisieren und in ihrer funktionsfähigen Form, zum Beispiel an einer Oberfläche, zu präsentieren.
Die Verwendung von Geruchsrezeptoren in der Biosensorik
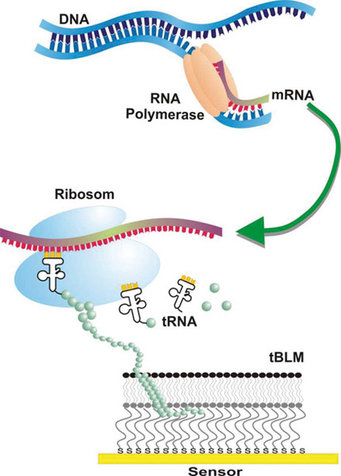
Membranproteine sind wegen ihrer vielfältigen und entscheidenden Rollen in der Biochemie einer Zelle im Fokus aktueller Forschungsaktivitäten. Neben der Untersuchung ihrer subtilen Struktur-Funktionsbeziehungen sind Membranproteine aus vielen Perspektiven heraus relevant: Grundlegende Prinzipien ihrer Funktions- und Regulationsmechanismen sind Gegenstand der Forschung; dabei gelten Membranproteine als wichtige Zielstrukturen wegen ihrer vielfältigen Funktionen, die sie im biochemischen Kontext einer Zelle ausüben. Nach dem Vorbild der Natur wird am MPI für Polymerforschung ein proteinbasierter Biosensor entwickelt, in dem Geruchsrezeptoren funktionell in eine synthetische Matrix integriert werden und damit für entsprechende experimentelle Methoden verfügbar gemacht wurden. Neu ist dabei die Kombination aus der klassischen zellfreien Proteinsynthese, der In-vitro-Transkription und -Translation, mit künstlich hergestellten Zellmembranen. Eingebunden in einen experimentellen Kontext können die oberflächengebundenen „biologisch-inspirierten“ Funktionssysteme im Einzelnen untersucht und durch die Anwendung zellfreier Proteinexpression erstmals auch so komplizierte Membranproteine wie Geruchsrezeptoren für sensorische und analytische Zwecke reproduzierbar und gerichtet in die künstlichen Membransysteme eingesetzt werden (siehe Abb. 1).
Ein mögliches Forschungsziel besteht darin, die Prinzipien der Natur zu verstehen, um wichtige Signale der Umgebung zu detektieren. Aus diesem Ansatz entwickelte sich die Biosensorik – ein aktuelles Forschungsgebiet, das sich zur Aufgabe gemacht hat, die molekularen Grundlagen von Bindungsvorgängen aus der Natur zu verstehen und umzusetzen, wie beispielsweise den Detektionsmechanismus einzelner Duftstoffmoleküle, wie er von der Insektenwelt bekannt ist.
Die Nachahmung biologischer Prozesse mit synthetisch hergestellten Molekülen ist eine Variation, die am MPI für Polymerforschung in das entsprechende wissenschaftliche Umfeld exzellenter Chemie und physikalischer Messmethoden passt. Dabei ist auch schon lange bekannt, dass die Struktur biologisch-inspirierter Moleküle für ihre Funktion von ausgesprochener Bedeutung ist. Es gibt eine aktive Struktur biologischer Moleküle, die es zu erhalten gilt, will man die Funktion bewahren – um nur ein Beispiel zu nennen: Aus einem gekochten Ei wird kein Küken mehr schlüpfen, da die funktionellen Strukturen zerstört wurden. Bislang wurden so genannte zellbasierte Systeme verwendet, um Geruchsrezeptoren – und überhaupt Membranproteine – untersuchen zu können. Am MPI für Biochemie wurde eine geeignete Zelllinie identifiziert, die Geruchsrezeptoren funktionell und in vergleichbar großen Mengen herstellt: die Mäusekrebszelllinie P19, die als Vorläuferzellen die Möglichkeit zur induzierten Differenzierung in Nervenzellen besitzen. Diese Zellen scheinen aufgrund ihres stammzellnahen Ursprungs die nötige Ausstattung zu besitzen, um fremde Geruchsrezeptoren „verstehen“ zu können, und die entsprechende Regulation geruchsrezeptorspezifischer Komponenten konnte zweifelsfrei gemessen werden. Ebenfalls erfolgreich waren die Experimente in einem Hefesystem, was die Synthese von Geruchsrezeptoren betraf – aber letzten Endes führten beide Strategien immer zu dem Punkt, die Rezeptoren aus ihrem natürlichen Kontext, der Membran, herauslösen zu müssen, um sie anschließend in die künstliche Matrix einbauen zu können.
Dieser Engpass sollte nun umgangen werden und die Geruchsrezeptoren de nuce, also nach ihrer Entstehung, sofort und ohne weitere Reinigungsschritte in den Membrankontext eingeführt werden. Die sehr vereinfachte Vorstellung ist hierbei, dass die Ribosomen aus dem zellfreien Extrakt die entstehende Aminosäurekette direkt in die künstliche Membran einfädeln, so wie es am endoplasmatischen Retikulum der Zelle passiert.
Die zellfreie Synthese von Geruchsrezeptoren
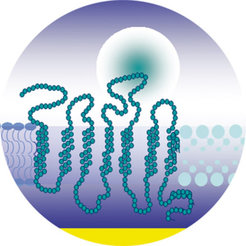
Die experimentelle Grundlage dieses Konzeptes liegt in der Kombination zweier bekannter Strategien: der zellfreien Synthese von Proteinen (der so genannten In-vitro-Transkription und -Translation) und die artifiziellen Membranen: an Oberflächen kovalent angebundene Lipidschichten, die in ihrem Aufbau einer Zellmembran gleichen [2] (s. Abb. 2).
Ein Zellextrakt wird auf diese präparierten Oberflächen zusammen mit der genetischen Information des Geruchsrezeptors gegeben. Mittels optischer Methoden, die oberflächenspezifische Fluoreszenz detektieren können, und parallel unter Einsatz klassischer biochemischer Nachweismethoden konnte die Existenz von synthetisierten Rezeptoren gezeigt werden.
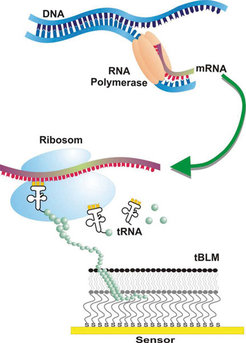
Die Geruchsrezeptoren werden in der Lipidmembran eingebettet und bleiben in ihrer funktionellen Struktur erhalten, wie erste infrarotspektroskopische Aufnahmen zeigen. Die biologische Aktivität kann dabei durch den Bindungsvorgang eines bekannten Geruchsstoffes nachgewiesen werden. Damit ist eine experimentelle Plattform geschaffen worden, an der die molekulare Grundlage des Geruchssinns detailliert untersucht werden kann [3]. Auch stellt dieser Ansatz eine Alternative zum Tiermodell dar, das bislang zum Verständnis des Geruchssinnes herangezogen werden musste.
Mittlerweile konnten am MPI für Polymerforschung auch weitere Beispiele für Membranproteine durch das beschriebene Verfahren hergestellt und untersucht werden – im nächsten Schritt wird im Rahmen eines Projektes, gefördert von der Europäischen Union [4], die Lipidmembran durch Blockcopolymere [5, 6] ersetzt. Dadurch wird die Membranoberfläche stabil gegenüber Luft. Die Bibliotheken an geeigneten Molekülen, die synthetisch hergestellt und im Detail charakterisiert sind, ermöglichen es, weitere prinzipielle Details von Membranproteinen in ihrer funktionellen Umgebung zu verstehen. Die Maschinerie der Proteinsynthese und Insertion ist nach wie vor ein Geheimnis der Natur.