Bilder von Gasen
Forschungsbericht (importiert) 2003 - Max-Planck-Institut für Polymerforschung
1. Einleitung
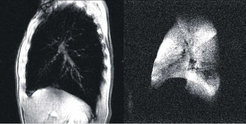
Bildgebende Verfahren haben die medizinische Diagnostik revolutioniert. Deshalb wurde letztes Jahr nach der Röntgen-Computertomographie auch die Erfindung der Kernspintomographie (engl. MRI für magnetic resonance imaging) mit der Verleihung des Nobelpreises an P. Lauterbur und P. Mansfield gewürdigt. Beide Verfahren ergänzen sich hervorragend. Während das erste den Absorptionskoeffizienten des Gewebes für Röntgenstrahlen darstellt und damit besonders gut für dichte Körperpartien (z.B. Knochen) geeignet ist, benutzt das zweite die Resonanz der magnetischen Momente der Atomkerne als Signalquelle. Besonders starke Signale besitzt das Wasserstoffatom, welches in Form von Wasser bis zu 75% des Körpers ausmacht. Unterschiedliche Gewebe führen zusätzlich zu unterschiedlichen Relaxationszeiten (d.h. Aufbau- und Abklingzeiten des Signals), die dann eine detaillierte Kontrastierung insbesondere des Weichgewebes ermöglichen. Durch die Kombination beider Verfahren sowie geeignete Kontrastmittel ist damit beinahe der ganze menschliche Körper dreidimensional darstellbar. Eine Ausnahme bildeten dabei die Atemwege und Lunge, welche bisher weder mit Röntgen noch MRI brauchbar abzubilden waren. Einzig Szintigraphie mit radioaktiven Gasen erlaubte eine allerdings sehr grobe Darstellung, da deren Konzentration aus Strahlenschutzgründen gering gehalten werden musste. Erst vor wenigen Jahren gelang es durch optische Anregung mit polarisiertem Laserlicht extrem hoher Leistung Gase derart zu präparieren, dass sie trotz ihrer geringen Dichte ausreichend Signal geben, um Bilder von Gasen zu ermöglichen (vgl. Abb. 1).
Um diese neuartigen diagnostischen Möglichkeiten optimal nutzen zu können, müssen die Produktion der polarisierten Gase, deren Verabreichung und die Art des Experiments in grundlegenden Experimenten optimiert werden. Daneben muss die Anwendung der Technik in klinischen Studien bezüglich ihres diagnostischen Potenzials bei verschiedenen Krankheitsbildern überprüft werden. Dazu wurde von dem Institut für Physik, der Klinik für Radiologie und Anästhesiologie der Universität Mainz sowie dem MPI für Polymerforschung eine von der DFG finanzierte Forschergruppe gegründet. Der Aufbau der neuen Messeinrichtung wurde freundlicherweise von der MPG aus privaten Mitteln finanziert.
2. Polarisation von Gasen mit Lasern
Kernmagnetische Resonanzspektroskopie (engl. NMR für nuclear magnetic resonance) nutzt den Magnetismus der Atomkerne einiger Isotope, eine der energetisch schwächsten Eigenschaften der Materie. Dies macht zum einen den Erfolg der NMR aus, denn im Unterschied zu anderen spektroskopischen Methoden kann diese Wechselwirkung apparativ sehr gut manipuliert werden. Andererseits ist die Energie so gering, dass bei Raumtemperatur statistisch nur jeder millionste Atomkern zum Signal beiträgt, d.h., die Polarisation der Probe beträgt 10-6. Dies ließ sich bisher nur durch drastisches Absenken der Temperatur (< 10 K) oder durch Erhöhen des polarisierenden Magnetfeldes verbessern. Generell ist NMR aber eine wenig sensitive Methode, was auch die mit MRI erreichbare Ortsauflösung limitiert.
Verschiedene Experimente wurden deshalb vorgeschlagen, um die Polarisation von stärker polarisierten Zuständen zu übertragen. Eine Möglichkeit ist die Anregung des Elektronenspins mit polarisiertem Laserlicht, welcher dann auf den Kernspin übertragen wird. Mit dieser Methode lassen sich Polarisationen von ca. 0,1 bis 0,7 erreichen, d.h. ein Signalgewinn von 5 Größenordnungen, allerdings bisher nur an den Edelgasisotopen 3He und 129Xe.
Abbildung 2 zeigt den apparativen Aufbau, der hierfür am MPI für Polymerforschung entwickelt wurde.

3. NMR-Bildgebung (MRI) an Gasen
Ein Signalanstieg von 5 Größenordnungen kompensiert die etwa 3 Größenordnungen geringere Dichte von Gasen gegenüber Flüssigkeiten und Festkörpern zwar ausreichend, aber eine weitere Eigenschaft der Gase macht sich bei der Aufnahme von Bildern negativ bemerkbar: die extrem schnelle Teilchenbewegung. Obwohl es zur Erzeugung eines ortskodierten NMR-Signals nur einer Zeit von 1-2 Millisekunden bedarf, macht sich dieser Effekt deutlich in einem Signalverlust bemerkbar. Dies liegt darin begründet, dass das Signal der Gasteilchen, welche sich am Ende des Experiments an einem anderen Ort befinden als zu Beginn, nicht vollständig erhalten bleibt. Dieser Effekt steigt stark nicht-linear mit der Geschwindigkeit der Teilchenbewegung und der Zeit an.
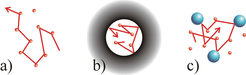
Die Geschwindigkeit der Teilchenbewegung wird durch deren kinetische Energie bestimmt, welche sich durch Erniedrigung der Temperatur oder Steigerung des Drucks verringern ließe. Jedoch sind diese Eigenschaften bei klinischen Untersuchungen keine Variablen. Diese freie ungehinderte Bewegung der Gasteilchen ist in Abbildung 3a schematisch verdeutlicht. Kollisionen mit anderen Teilchen führen zu der typischen Zick-Zack-Bewegung, der Brown’schen Bewegung, deren statistische Ausbreitungsgeschwindigkeit durch eine Diffusionskonstante beschrieben wird.
Nun ist in realen Proben die Ausbreitung von Teilchen nur selten wirklich frei. Interessante Proben zeichnen sich zwangsläufig durch innere Strukturen, z.B. Poren, aus. Ist der Durchmesser einer solchen Pore kleiner als der vom Gasteilchen während der Beobachtungszeit zurückgelegte Weg, so bestimmt nicht länger allein die Kinetik und Dichte der Teilchen die Diffusionsstrecke, sondern im Wesentlichen eine strukturelle bzw. morphologische Eigenschaft der Probe (vgl. Abb. 3b).
Trotzdem ist es für viele Fragestellungen wichtig, die Einschränkung der Diffusion nicht nur zu erkennen, sondern auch aktiv beeinflussen zu können. Um größere Gefäße mit ähnlicher Qualität abbilden zu können, ist es daher unvermeidbar, die Diffusion einzuschränken. Ein einfacher Trick besteht darin, schwere Puffergase zuzugeben, die wie die Wände einer Pore wirken und die kleineren Teilchen an einer schnellen Ausbreitung hindern (vgl. Abb. 3c).
Wie drastisch dieser Effekt ausfallen kann, ist in Abbildung 4 demonstriert, wo Laser-polarisiertes 3He-Gas in einem relativ großen Glasgefäß eingebracht wurde. Der einzige Unterschied zwischen der extrem signalarmen Abbildung 4b und dem gut sichtbaren Gas in Abbildung 4c ist die Beimischung von 50% SF6 (einem inerten Puffergas mit großer Molekularmasse), d.h., der Signalträger wurde in Abbildung 4c sogar verdünnt. Dies führt zu der geradezu paradox anmutenden Feststellung, dass weniger signalgebendes Gas unter Umständen zu mehr Signal führen kann.
Neben der Geschwindigkeit zeigen die beiden Laser-polarisierbaren Edelgase Helium und Xenon aber auch noch andere Unterschiede. Obwohl chemisch inert, ist das gut fettlösliche Xenon ein starkes Anästhetikum und sein NMR-Spektrum ist extrem empfindlich auf kleinste Veränderungen seiner Umgebung. Deshalb eignet es sich hervorragend zur Erforschung der Lungenfunktion, weil sein Spektrum den Übergang aus der Gasphase in die Blutbahn anzeigt. Helium dagegen ergibt aus mehreren Gründen ein besseres Signal und eignet sich deswegen ausgezeichnet zur Untersuchung der Morphologie und Ventilation.

4. Anwendung: Funktionalisierte Bilder der Lunge
Wie eingangs schon erwähnt, ist MRI mit Laser-polarisierten Gasen zur dreidimensionalen Abbildung der Lunge als Verfahren konkurrenzlos. Entsprechend ist bereits die rein anatomische, morphologische Beurteilung eines Krankheitsbildes, d.h., die Lunge einfach in bis dahin nicht bekanntem Detail darzustellen, ein deutlicher diagnostischer Fortschritt.
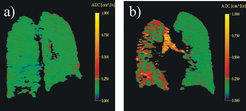
Aber es ist noch mehr möglich. Indem man zum Beispiel das Signal übermäßig auf die oben beschriebene Diffusion empfindlich macht, gelingt es, Strukturen (Verteilung von Porengrößen) als Kontrast in das Bild zu integrieren, die deutlich unterhalb der Ortsauflösung (ca. 1 mm) liegen. Dies kann für die Diagnose solcher Krankheiten entscheidend sein, die mit der Veränderung der kleinsten Strukturen der Lunge — die Alveolen (Durchmesser 100 - 200 μm) — einhergeht. Abbildung 5 zeigt dies deutlich am Beispiel eines Lungenemphysems. Hierzu wurde nun nicht mehr nur die räumliche Verteilung des Gases dargestellt, sondern ein Bild des lokalen Diffusionskoeffizienten berechnet, der das prinzipiell in Abbildung 4a und 4b dargestellte Szenario zur klinischen Diagnose umsetzt. Das Emphysem zerstört die Lungenbläschen (Alveolen), wodurch größere Hohlräume entstehen. Diese sind zwar immer noch viel zu klein, um sie direkt im Bild erkennen zu können, aber der lokale Diffusionskoeffizient zeigt diese Symptomatik durch höhere Werte (rote Farben) an, weil die "Poren" größer werden.
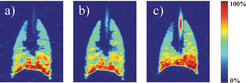
Eine ähnliche Vorgehensweise kann durch Zumischung inerter Puffergase erreicht werden. Wie oben erklärt, lässt sich auf diese Weise der Diffusionskoeffizient kontrollieren und damit ein Grenzwert einstellen, ab welchem die Gasteilchen die Wände einer Pore "spüren". Abbildung 6 zeigt dies am Beispiel einer Schweinelunge, die mit Gasen unterschiedlicher Molmasse gefüllt wurde. Anschließend wurde jeweils die gleiche Menge Laser-polarisiertes 3He eingespült. Je nach Gasgemisch treten nun Strukturen mit verschiedener Größe unterschiedlich stark hervor. Auf diese Weise kann man z.B. selektiv nur die kleinsten Verästelungen der Lunge hervorheben [3].
Die Funktionsweise der Lunge — d.h. die Aufnahme von Sauerstoff ins Blut — kann ebenfalls indirekt nachgewiesen werden, weil eine erhöhte Sauerstoffkonzentration die Abnahme der Polarisation des Gases beschleunigt [4]. Das Resultat ist dann ein Bild des lokalen Partialdrucks von Sauerstoff.
5. Ausblick
Aufgrund der hohen Kosten und des großen technischen Aufwands ist das Verfahren natürlich noch weit davon entfernt, in das Repertoire klinischer Standarddiagnostik aufgenommen zu werden. Nachdem viele grundsätzliche Fragestellungen geklärt wurden und die prinzipielle Anwendung demonstriert ist, muss nun in klinischen Studien die Relevanz und das diagnostische Potenzial evaluiert werden.
Neben der Weiterentwicklung der klinischen Lungendiagnostik ist das Verfahren natürlich auch für biophysikalische und materialwissenschaftliche Fragestellungen hoch interessant. Insbesondere poröse Materialen und Membranen sollen durch Laser-polarisierte Gase besser charakterisiert werden.
Literatur
[1] M. Ebert, T. Grossmann, W. Heil, W. E. Otten, R. Surkau, M. Leduc, P. Bachert, M. V. Knopp, L. R. Schad, M. Thelen: Nuclear magnetic resonance imaging with hyperpolarised helium-3. Lancet 347
(9011), 1297-1299 (1996).
[2] G. Hanisch, W. G. Schreiber, T. Diergarten, K. Markstaller, B. Eberle, H. U. Kauczor, T. Grossmann, M. Thelen: Investigation of Intrapulmonary Diffusion by 3He MRI. European Radiology 10, 34 (2000).
[3] R. H. Acosta, P. Blümler, L. Agulles-Pedrós, A. E. Morbach, J. Schmiedeskamp, A. Herweling, U. Wolf, A. Scholz, W. G. Schreiber, W. Heil, M. Thelen, H. W. Spiess: Controlling the Diffusion of 3He by Buffer Gases as Structural Contrast Agent in Lung MRI. Journal of Magnetic Resonance Imaging, eingereicht.
[4] F. Lehmann, B. Eberle, K. Markstaller, K. K. Gast, J. Schmiedeskamp, P. Blümler, H. U. Kauczor, W. G. Schreiber: Ein Auswerteprogramm zur quantitativen Analyse von Messungen des alveolären Sauerstoffpartialdrucks (pAO2) mit der sauerstoffsensitiven 3He-MR-Tomographie. RöFo, im Druck.
![Links: Normales MRI-Schnittbild des Brustraums (links im Bild die Brust, rechts der Rücken) eines gesunden Probanden. Die Lunge erscheint bis auf die Blutgefäße als signalfreier Raum. Der Kontrast lässt sich durch Einatmen von Laser-polarisiertem 3He umkehren (rechtes Bild). Diese Bilder sind die erste Demonstration des Verfahrens [1]. Links: Normales MRI-Schnittbild des Brustraums (links im Bild die Brust, rechts der Rücken) eines gesunden Probanden. Die Lunge erscheint bis auf die](https://www.mpg.de/855429/original-1294357472.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6ODU1NDI5fQ%3D%3D--320ba49542313d6e1c2897c1fc23fffb6112d04e)



![Bilder des lokalen Diffusionskoeffizienten: a) gesunder Proband b) Patient mit einem Emphysem im linken Lungenflügel (rechter ist transplantiert). Die Farbskala gibt den Diffusionskoeffizienten wieder. Grüne Farbtöne entsprechen demjenigen, der in gesunden Lungenbläschen zu finden ist. Rote Farbtöne zeigen weniger eingeschränkte Diffusion, wie sie durch das Emphysem hervorgerufen werden, aber auch in den großen Luftwegen (siehe Luftröhre in der Bildmitte) vorkommen [2]. Bilder des lokalen Diffusionskoeffizienten: a) gesunder Proband b) Patient mit einem Emphysem im linken Lungenflügel (rechter ist transplantiert). Di](https://www.mpg.de/855653/original-1294357514.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6ODU1NjUzfQ%3D%3D--4ded3d268d76e8a34a98427afd0f05a7f36fd89d)
