Wie man einen Darm im Labor simuliert
Forschungsbericht (importiert) 2021 - Max-Planck-Institut für Polymerforschung
Medikamente durchlaufen ein komplexes Testverfahren, bevor sie zum Einsatz kommen. Teil dieses Verfahrens sind oftmals Versuche an Tieren. Unter anderem ist hierbei wichtig, wie Medikamente durch die Zellwände des Darms bis ins Blut gelangen können. Um diesen Prozess auch in Laborexperimenten bereits simulieren zu können, haben wir in unserer Arbeit einen auf organischen Materialien basierenden Transistor entwickelt. Mit diesem lässt sich in unserem Versuchsaufbau die Durchlässigkeit von Zellschichten durch Messung ionischer Ströme messen.
Ob Schnupfen, Magen-Darm-Beschwerden oder Kopfweh: Jeder kennt und hasst es. Doch gegen viele dieser Krankheiten ist ein Kraut gewachsen: Medikamente helfen schnell, diese zu bekämpfen. Aber die Wirkstoffe, die sich in den Tabletten befinden, sind nur ein kleiner Teil dessen, was deren Wirksamkeit ausmacht.
Mit dem Wirkstoff durch die Wand
Schauen wir uns hierfür den Darm an. Auf sieben Metern Länge nimmt er Nährstoffe aus der im Magen zersetzten Nahrung auf. Auch Wirkstoffe von Medikamenten werden bis hierher transportiert, von dort in die Blutbahn transferiert und dann dorthin im Körper weitergeleitet, wo sie benötigt werden. Um nicht alle chemischen Verbindungen, die im Darm landen, in die Blutbahn weiterzugeben, ist in der Darmwand ein ausgefeiltes Filtersystem installiert, welches nur bestimmte Stoffe durchlässt. Teil dieses Systems sind die „Tight Junctions“ – englisch für „dichte Verbindung“ – die den Zwischenraum zwischen Zellen der Darmwand verschließen beziehungsweise die Zellen zusammenhalten. Diese sind in der Lage, den Fluss von Molekülen zu kontrollieren und bilden damit ein Filtersystem – eine sogenannte Diffusionsbarriere. Wirkstoffe müssen diese Barriere passieren, bevor sie ins Blut gelangen, weshalb moderne Medikamente Stoffe beinhalten, die diese Barriere kurzzeitig lockern.
Von der Maus zum Reagenzglas
Ein kritischer Punkt bei der Entwicklung neuer Medikamente ist damit auch, die Stoffe, die die Barriere lockern, so zu dosieren, dass sie nicht zerstört wird und sich selbstständig nach einiger Zeit regenerieren kann. Hierfür werden typischerweise Experimente mit Labortieren durchgeführt.
Bei der Arbeit in meiner Gruppe versuchen wir, ein künstliches System zu entwickeln, welches Vorhersagen darüber aus Laborexperimenten – sogenannten „in vitro“-Experimenten – möglich macht. Die Motivation, das Tiermodell zu ersetzen, zu reduzieren und zu redefinieren, legte die Europäische Union nicht zuletzt aus ethischen Beweggründen bereits im Jahr 2013 gesetzlich fest. Hauptaugenmerk unserer Arbeit liegt auf der Erforschung neuartiger Sensoren, die es erlauben, eine Aussage über die Funktionsfähigkeit sowie die Regeneration der Diffusionsbarriere zu machen.
Ionen, Zellen und Sensoren
Hierfür haben wir einen Versuch aufgebaut, der aus verschiedenen Komponenten besteht: Zunächst benötigen wir eine gezüchtete Barriere aus menschlichen Zellen, die mit „Tight Junctions“ verbunden sind. Hier bieten sich sogenannte „Caco-2-Zellen“ an - eine Zelllinie, wie sie in menschlichem Darmkrebs vorkommt. Sie ist in der Wissenschaft als Modellsystem anerkannt, da sie eine besonders starke Barriere ausbildet. Das gezüchtete Zellgewebe wird in unserem Experiment mithilfe einer porösen Membran in eine Elektrolytlösung eingebracht.
Innerhalb der Elektrolytlösung sind positiv wie auch negativ geladene Atome – das heißt Ionen – vorhanden. Diese können intaktes Zellgewebe nicht durchdringen. Wird ein chemischer Wirkstoff eingebracht, der die Tight Junctions löst, können Ionen die Schicht durchdringen. Je höher der Fluss der Ionen, desto stärker wurden die Junctions gelöst.
Um den ionischen Fluss zu messen, verwenden wir einen eigens von uns entwickelten Sensor, der auf einer seit den 1980er Jahren bekannten Technologie basiert ist – sogenannten organischen elektrochemischen Transistoren, kurz „OECT“.
Transistor – aber organisch!
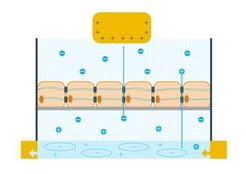
OECTs haben viele Eigenschaften, die bereits von konventionellen Transistoren bekannt sind: Zwischen zwei Anschlüssen, Source und Drain, wird eine Spannung angelegt. Der Widerstand zwischen den beiden Anschlüssen lässt sich über einen weiteren Anschluss – das Gate – regeln.
Unser OECT unterscheidet sich jedoch von diesem konventionellen Transistor: Source und Drain sind über einen leitfähigen Kanal, der aus einem porösen Polymer besteht, verbunden. Wird das Gate, welches sich oberhalb der Zellschicht befindet, positiv geladen, so stößt es positive Ionen ab – also in Richtung dieses Kanals. Aufgrund der Porösität können Ionen in das gesamte Volumen des Kanals eindringen und über eine elektrochemische Reaktion den Stromfluss zwischen Source und Drain beeinflussen.
OECTs gelten damit als „Übersetzer“ von Ionen- in Elektronenstrom – ideal also, um den Fluss der Ionen in der Elektrolytlösung, der von der Unversehrtheit der Barriere abhängt, in ein elektronisches Signal zu übersetzen.
Ein wichtiger Punkt bei der Entwicklung war unter anderem die Biokompatibilität: Das Vorhandensein von Wasser in biologischen Systemen erlaubt es nicht, mit hohen Spannungen zu arbeiten, weshalb wir unseren Transistor für niedrige Spannungen optimiert haben. Des Weiteren haben wir eine Messkonfiguration entwickelt, durch die sich eine besonders hohe Ionen-Sensivität erzielen lässt. Somit ist eine besonders genaue Messung auch kleinster ionischer Ströme noch möglich.
Auf und zu

Wir konnten unseren Transistor in einem ersten Experiment testen: Hierzu haben wir in dem Testaufbau die Barriere mit dem chemischen Stoff Poly-L-Lysine geöffnet. Es zeigte sich, dass der Stromfluss zunächst anstieg. Nach Austausch des Elektrolyten und damit der Entfernung des barriereöffnenden Stoffs regenerierte sich die Barriere selbstständig wieder innerhalb von mehreren Stunden, was wir live verfolgen konnten.
Für die Zukunft hoffen wir, dass unser Sensor das Tiermodell mehr und mehr ersetzen kann. Die Aussicht, künftig komplexe biologische Systeme, wie beispielsweise gezüchtete Organoide, mit mehr Funktionen zu untersuchen, bringt uns näher an das tatsächliche biologische System. Biosensoren eröffnen damit eine in-vitro Plattform, um pathologische Bedingungen zu untersuchen, ohne dabei lebende Organismen zu verwenden. Die genauere Untersuchung des Verhaltens einer biologischen Barriere auf chemische Stoffe ermöglicht in Zukunft gegebenenfalls auch den Zugriff auf das zentrale beziehungsweise das periphäre Nervensystem durch Manipulation der Blut-Hirn-Schranke. Insgesamt könnte so die Medikamentenforschung besser auf den Menschen angepasst und um ein Vielfaches beschleunigt werden.













