Mit dem Nano-U-Boot gezielt gegen Kopfschmerzen und Tumore
Neue Methode zum Transport von Medikamenten in „Nature Nanotechnology“ vorgestellt
Wissenschaftler des Max-Planck-Instituts für Polymerforschung (MPI-P) und der Universitätsmedizin Mainz haben eine neue Methode entwickelt, um kleinste mit Medikamenten gefüllte Nanocarrier an Immunzellen andocken zu lassen, die dann wiederum Tumore angreifen. Dies verspricht in Zukunft eine zielgenaue Behandlung, die eine Schädigung von gesundem Gewebe weitestgehend vermeiden kann. Ihre Untersuchungen haben die Wissenschaftler nun in dem renommierten Fachjournal „Nature Nanotechnology“ veröffentlicht.
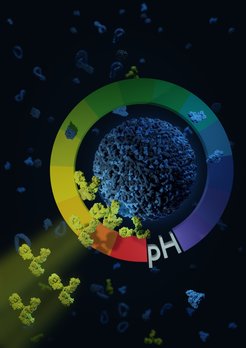
Zur Behandlung von Tumoren oder auch für die Schmerztherapie werden in der modernen Medizin häufig Medikamente verabreicht, die sich im gesamten Körper verteilen, obwohl der medizinisch zu behandelnde Organteil nur klein und abgegrenzt ist. Abhilfe verspricht ein zielgerichteter Transport von Medikamenten zu bestimmten Zelltypen. Vor diesem Hintergrund arbeiten Wissenschaftler an der Entwicklung sogenannter Nanocarrier: Dabei handelt es sich quasi um Miniatur-U-Boote mit einer Größe von ungefähr einem Tausendstel des Durchmessers eines menschlichen Haares. Diese mit dem bloßen Auge nicht erkennbaren Nanocarrier werden mit einem medizinischen Wirkstoff befüllt und dienen somit als konzentrierte Transportbehälter. Die Oberfläche dieser Nanocarrier beziehungsweise Medikamentenkapseln gilt es so zu beschichten, dass sie beispielsweise an mit Krebszellen durchsetztem Gewebe andocken können. Für die Beschichtung werden meist Antikörper verwendet, die wie ein Adressaufkleber an den zu adressierenden Zellen – wie etwa Tumorzellen oder Immunzellen, die Tumore angreifen – eine Bindestelle vorfinden.
Das Team um Prof. Dr. Volker Mailänder von der Hautklinik der Universitätsmedizin der Johannes Gutenberg-Universität Mainz (JGU) hat nun eine neue Methode entwickelt, die Antikörper mit der Medikamentenkapsel auf eine genial einfache Weise zu verbinden: „Bisher mussten diese Antikörper aufwendig mit chemischen Methoden an die Nanokapseln gebunden werden“, so Mailänder. „Wir haben nun nachgewiesen, dass es ausreicht, Antikörper und Nanokapsel in einer angesäuerten Lösung zusammenzuführen.“
Die Forscherinnen und Forscher heben in ihrer Veröffentlichung im Fachjournal „Nature Nanotechnology“ hervor, dass die Verbindung von Nanokapsel und Antikörper auf diese Art und Weise etwa doppelt so effizient im Reagenzglas funktioniert – und damit auch der zielgerichtete Medikamententransport entscheidend verbessert werden kann. Unter Bedingungen, wie sie im Blut vorherrschen, verlor zudem der chemisch gekoppelte Antikörper fast vollständig seine Wirksamkeit, während der nicht-chemisch aufgebrachte Antikörper weiterhin funktional blieb.
„Die bisher übliche Anbindung über komplexe chemische Verfahren kann dazu führen, dass der Antikörper verändert oder gar zerstört wird beziehungsweise der Nanocarrier im Blut schnell mit Proteinen zugesetzt wird“, so Prof. Dr. Katharina Landfester vom Max-Planck-Institut für Polymerforschung. Die neue Methode, die auf dem physikalischen Effekt der sogenannten Adsorption oder „Anhaftung“ basiert, schützt den Antikörper. Hierdurch wird der Nanocarrier stabiler und kann somit effektiver die Medikamente im Körper verteilen.
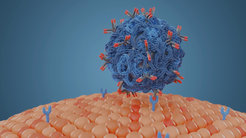
Die Forscher haben zur Entwicklung ihrer neuen Methode Antikörper und Medikamententransporter in einer sauren Lösung zusammengebracht. Dies führt – im Gegensatz zu einer Verbindung bei einem neutralen pH-Wert – zu einer effizienteren Besetzung der Nanopartikel-Oberfläche. Laut den Forschern bleibt auf dem Nanocarrier somit weniger Platz für Blutproteine, die das Andocken an eine Zielzelle verhindern könnten.
Insgesamt sind sich die Forscher sicher, dass die neu entwickelte Methode Effizienz und Anwendbarkeit von auf Nanotechnologie basierende Therapieverfahren in Zukunft erleichtern und verbessern wird.
Über das Projekt
Dieses Projekt wird durch den Sonderforschungsbereich SFB 1066 “Nanodimensional polymer therapeutics for tumor therapy” der Deutschen Forschungsgemeinschaft (DFG) und durch das Forschungszentrum Immuntherapie (FZI) der Johannes Gutenberg-Universität Mainz finanziert.













